Inhaltsverzeichnis
Weitere Übung zu pKs-Werte
zur selbstständigen Bearbeitung
- Gib an, was man unter einer starken und unter einer schwachen Säure versteht (ein Blick ins Buch ist hier sicher hilfreich).
- „Wenn die wässrige Lösung der Säure A einen niedrigeren pH-Wert hat als die Lösung der Säure B, dann ist die Säure A stärker als die Säure B.“
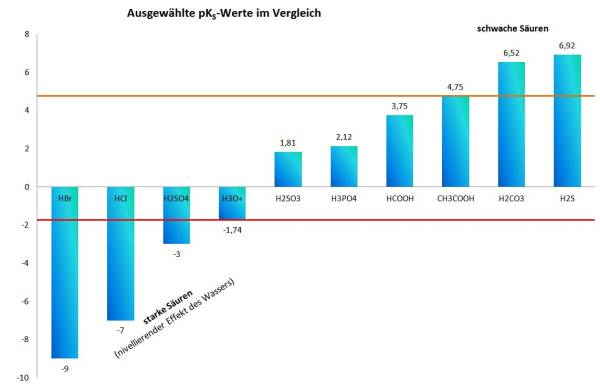
Dieser Satz ist nicht allgemeingültig. Markiere die Stelle, an der für die Allgemeingültigkeit etwas ergänzt werden muss und formuliere diese Ergänzung. - Erstelle ein Säulendiagramm, in dem die pKS-Werte der folgenden Säuren dargestellt werden (Werte aus der Formelsammlung, S. 138), sortiere die Säuren vorher nach ihrer Stärke:
Essigsäure, Hydronium-Ion, Salzsäure, Schwefelwasserstoff, Schweflige Säure, Kohlensäure, Schwefelsäure, Phosphorsäure, Bromwasserstoff, Ameisensäure.
Hilfe: Formeln der Säuren (immer (aq) dazu denken) – müssen noch zugeordnet werden… HBr, HCl, H2CO3, H3O+, H3PO4, H2S, H2SO3, H2SO4, HCOOH, CH3COOH - Wiederhole den (+)-I-Effekt. Versuche dann, die Unterschiede in den pKS-Werten von Essigsäure (4,75), Trichloressigsäure (0,64) und Trimethylessigsäure (5,05) zu erklären.
Auch der pKS-Wert der Oxalsäure (1,25) weicht deutlich von dem der Essigsäure ab. Vermutungen?
Starke und schwache Säuren
Begriff im Stichwortverzeichnis von Chemie heute: „Säurestärke“
Eintrag S. 112: „Säuren, die in verdünnten Lösungen vollständig protolysieren, bezeichnet man als starke Säuren.“
Säuren, bei denen das Massenwirkungsgesetzt zum Tragen kommt, die also nicht vollständig protolysieren, bezeichnet man dann als schwache Säuren. Ein Hinweis auf die Säurestärke liefert die Säurekonstante.
Eintrag S. 266: „Die im Vergleich zu Alkoholen recht hohe Säurestärke der Carbonsäuren ist auf den negativen Induktionseffekt (-I-Effekt) des Carbonyl-Sauerstoffatoms zurückzuführen.“ „Die Änderung des pKS-Wertes in der homologen Reihe der Alkansäuren beruht auf dem positiven Induktionseffekt (+I-Effekt) des Alkylrestes.“
Säurestärke und pH-Wert
„Wenn die wässrige Lösung der Säure A bei gleicher Konzentration einen niedrigeren pH-Wert hat als die Lösung der Säure B, dann ist die Säure A stärker als die Säure B.“
Graphischer Vergleich
Struktur und Säurestärke
Induktionseffekt (Chemie heute, Glossar, S. 422): Die Elektronendichte in einem Molekülteil wird durch die beeinflussende Wirkung der funktionellen Gruppe verändert.
- -I-Effekt: elektronenziehende Wirkung der funktionellen Gruppe
Elektronendichte wird erniedrigt
- +I-Effekt: elektronenschiebende Wirkung der funktionellen Gruppe
Elektronendichte wird erhöht
Trichloressigsäure (pKS = 0,64), CCl3COOH:
Chlor als Substituent zeigt durch die hohe Elektronegativität einen deutlichen -I-Effekt, damit wird die das Proton der Essigsäure sehr viel leichter abgespalten.
Essigsäure (pKS = 4,75), CH3COOH: „Standard“
Trimethylessigsäure (pKS = 5,05), C(CH3)3COOH:
Die Methylgruppe (kleinster Alkylsubstituent) zeigt einen +I-Effekt, damit wird die O-H-Bindung der Carboxylgruppe stabilisiert und das Proton nicht so leicht wie in der Essigsäure abgespalten.
Oxalsäure (pKS = 1,25), HOOCCOOH:
Ein kleiner Effekt mag der +I-Effekt der Methylgruppe in der Essigsäure im Vergleich zur Carboxylgruppe sein. Wesentlich ist hier jedoch eine strukturelle Begründung: Wenn die Oxalsäure ein Proton abspaltet, kann das Oxalat durch eine interne Wasserstoffbrücke einen stabilen Ring bilden. Daher ist die Rückreaktion behindert und das Gleichgewicht liegt stärker auf der Seite der Protolyseprodukte.