Inhaltsverzeichnis
Übung 1 Saure und alkalische Lösungen im Alltag
Aufgabe 1 - Sanitärreiniger
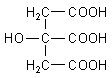 saure WC-Reiniger: Natriumhydrogensulfat (NaHSO4) und Citronensäure (H3Cit, Summenformel C6H8O7)
saure WC-Reiniger: Natriumhydrogensulfat (NaHSO4) und Citronensäure (H3Cit, Summenformel C6H8O7)
alkalische Sanitärreiniger: Natriumhypochlorit(NaClO) und Natriumchlorid (NaCl)1)
Teilchen in der wässrigen Lösung
sauer: Na+, HSO4-, H3O+, H2Cit- (pKS = 3,13), daneben auch HCit2- (pKS = 4,47) und Cit3- (pKS = 5,39) 2)
alkalisch: Na+, ClO-, Cl-
Ergänzung: Brönsted-Reaktionen
sauer, 1: HSO4- + H2O ←→ SO42- + H3O+ (pKS = 1,92) sauer, 2: H3Cit + H2O ←→ H2Cit- + H3O+ (pKS = 3,13)
alkalisch: ClO- + H2O ←→ HClO + OH- (pKS(HClO) = 7,53)
gemeinsamer Einsatz
2 H3O+ + ClO- + Cl- ←→ Cl2 + 3 H2O
Sulfat und Citrate wurden in dieser Gleichung nicht berücksichtigt.
Aufgabe 2 - Öffnung einer Mineralwasserflasche
H2CO3 ←→ CO2 + H2O
Diese Reaktion ist endotherm und verläuft daher bei hohen Temperaturen heftiger. Durch den dann erhöhten Gasdruck kann die Mineralwasserflasche platzen.
Aufgabe 3 - Entkalken
CaCO3 (s) + 2 CH3COOH (aq) → Ca2+ (aq) + CO2 (g) + H2O + 2 CH3COO- (aq)3)
pH-Wert des verwendeten Essigs
c0 = 0,9 mol/l Ks(CH3COOH)) = mol/l
c(H3O+) = =
= 0,0040 [mol/l]
pH = -lg(c(H3O+) = 2,40
Restkonzentration nach dem Entkalken
Eingesetzt: 1 l Essigsäure mit c0 = 0,9 mol/l, also 0,9 mol Essigsäure
gemessener pH-Wert: 3,8 c(H3O+) =
[mol/l]
aus ergibt sich die Restkonzentration:
[mol/l]
Masse an gelöstem Calciumcarbonat
Die Restkonzentration an Essigsäure beträgt 0,0014 mol/l, von den ursprünglich 0,9 mol Essigsäure sind also nur noch 0,0014 mol vorhanden.
Damit wurden 0,8986 mol Essigsäure verbraucht.
Nach der Reaktionsgleichung werden 2 mol Essigsäure beim Auflösen von 1 mol Calciumcarbonat umgesetzt. Demnach wurden also 0,4493 mol Calciumcarbonat gelöst.
Da Calciumcarbonat eine Molmasse von 100 g hat, wurden also 44,93 g Calciumcarbonat aufgelöst.
